Zusammenfassung
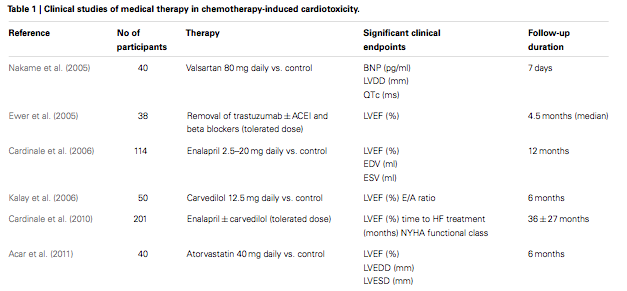
Das Risiko für Kardiotoxizität wächst mit der kumulativen [also insgesamt eingenommenen] Dosis. Studien, welche die kumulative Wahrscheinlichkeit von doxorubizin-induzierte Herzinsufizienz ausgewertet haben, fanden folgende Raten
- 3% - 5% mit 400 mg/m2 Körperoberfläche,
- 7% - 26% mit 550 mg/m2 Körperoberfläche,
- 18% - 48% mit 700 mg/m2 Körperoberfläche,
Die empfohlene maximale kumulative Lebenszeitdosis für Doxorubizin ist 400 - 550 mg/m2 Körperoberfläche.
Diagramm (in cache), das die Körperoberfläche aus Gewicht und Größe bestimmen lässt.
Für 1.6 m2 Körperoberfläche (mittlerer Wert für Frauen) ergeben sich damit folgende Dosen
- 3% - 5% mit 640 mg,
- 7% - 26% mit 880 mg,
- 18% - 48% mit 1120 mg,
- empfohlene maximale kumulative Lebenszeitdosis für Doxorubizin ist 640 - 880 mg
Nach der Behandlung mit Anthrazyklinen ist es wichtig, die Herzfunktion aller Patienten erneut auszuwerten, um asymptomatische (symptomlose) Patienten mit erhöhter Herzschädigung zu identifizieren.
Die gemessenen LVEF-Werte variieren beträchtlich, weil Krebsmedikament-unabhängige Faktoren wesentlichen Einfluss auf die Herzfunktionen haben können. ... die LVEF-Messung ist ein relativ unempfindliches Werkzeug zum Entdecken von Kardiotoxizität im Frühstadium. Das kommt weitgehend daher, dass keine nennenswerte LVEF-Änderung auftritt, bis ein kritischer Betrag an Herzmuskelschädigung stattgefunden hat, und sie erst dann in den Vordergrund tritt, nachdem Ausgleichsmechanismen erschöpft sind. Darüberhinaus bereitet eine LVEF-Messung eine Anzahl von Herausforderungen, was die Bildqualität, die Annahme der linksventrikulären Geometrie, Abhängigkeit von der Belastung und [Facharzt-]Expertise angeht.
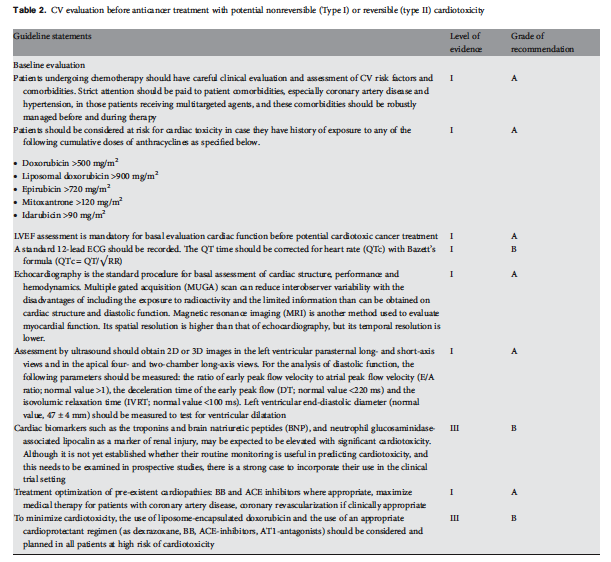
Tabelle 3: Kardiovaskuläre Beobachtung während und nach Krebstherapie with potentiell nicht-reversibler (Typ I) oder reversibler (Typ II) Kardiotoxizität
|
Leitlinien-Aussage |
Beweisgrad |
Empfehlungsgrad |
|
s. engl. Text rechts |
|
|
|
s. engl. Text rechts |
|
|
|
s. engl. Text rechts |
|
|
|
s. engl. Text rechts |
|
|
|
s. engl. Text rechts |
|
|
|
Aggressive medizinische Behandlung von Patienten, auch wenn ohne Symptome, die linksventrikuläre Dysfunktion (LVD) im DEchokariogramm nach Therapie mit Anthrazyklinen haben, ist zwingend, besonders wenn der Krebs langlebig sein könnte; sie besteht aus ACE-Hemmern und Beta-Blockern, und je früher die Herzinsuffizienztherapie begonnen wird (innerhalb von 2 Monaten nach der Anthrazyklintherapie), desto besser ist das Therapieergebnis. |
II |
B |
Zeichenerklärung
Quelle: Evidence Based Health Care -- Practice guidelines levels of evidence and grades of recommendations used by the National Guideline Clearinghouse (cached)
- I Nachweis durch Meta-Analyse von (einem oder mehreren) randomisierten kontrollierten Tests
- II Nachweis durch wenigstens eine kontrollierte nicht randomisierte Studie oder wenigstens einen anderen Typ einer quasi-experimentellen Studie
- III Nachweis durch nicht-experimentelle beschreibende Studien, wie vergleichende Studien, Korrelationsstudien und Fall-kontrollierte Studien.
- A Direkt auf Level-I-Nachweis basiert.
- B Direkt auf Level-II-Nachweis basiert oder von Level-I-Nachweis extrapolierte Empfehlung.
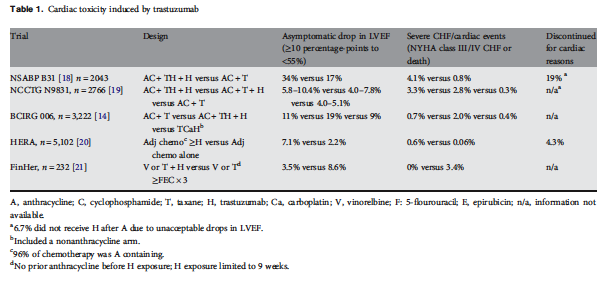
Behandlung von Trastuzumab-Kardiotoxizität
Behandlung von Kardiotoxizität durch Trastuzumab hat zwei unterschiedliche Aspekte:
- Beenden der Trastuzuma-Therapie and
- Behandlung der Herz-Fehlfunktion
Symptomatischer linksventriklärer Dysfunktion muss mit Herzinsuffizienz-Behandlung begegnet werden:
- Alle Patienten mit Herzinsuffizienz und einer LVEF <40% sollten mit einem Angiotensin-Converting Enzyme-Hemmer (ACE-Inhibitor, ACE-I) in Verbindung mit einem Betablocker (BB) behandelt werden, außer wenn eine spezifische Kontraindikation vorliegt [I, A].
- Einige Mitglieder des [Leitlinien-]Panels meinten auch, dass zur Verhütung weiterer Verschlimmerung der LVEF oder der Entwicklung einer klinisch manifesten Herzinsuffizienz ein ACE-I sollte in Erwägung gezogen werden, wenn die LVEF des Patienten zwischen 40% und 50% liegt.
Symptomfreie (asymptomatische) Herzinsuffizienz sollte wie folgt behandelt werden:
- ACE-Is sollten verwendet werden bei linksventrikulärer Dysfunktion und LVEF < 40%
- bei LVEF 35%: I, A,
- bei LVEF 35% - 40%: I, B.
- Ein ACE-I sollte auch bei LVEF < 50% in Erwägung gezogen werden.
- BB sollten bei allen Patienten mit asymptomatischer linksventrikulärer Dysfunktion (LVD) und einer LVEF < 40% in Erwägung gezogen werden
- bei vorherigem Herzmuskelinfarkt: I, B
- sonst: II, C
Obwohl Chemotherapie-bezogene Herzischämie eine ungewöhnliche Erscheinung ist, hat man ein erhöhtes Risiko für akutes Koronarsyndrom assoziiert mit der Anwendung von zellschädigenden (zytotoxischen) und gezielten Krebsmedikamenten.
Tabelle 4: Behandlung von linksventrikulärer Dysfunktion nach einer Krebstherapie mit nicht-reversibler (Typ I) und reversibler (Typ II) Kardiotoxizität
|
Leitlinien-Aussage |
Beweisgrad |
Empfehlungsgrad |
|
Bei Patienten mit subklinischer Typ-I-Kardiotoxizität, die auch durch erhöhtes Herz-Troponin identifiziert ist, könnte eine Behandlung mit ACE-I (enalapril) einer LVEF-Verringerung und damit verbundenen Herzerscheinungen vorbeugen. |
II |
A |
|
Patienten, die Herzdysfunkion während oder nach Behandlung mit Typ II Mitteln (Trastuzumab) in Abwesenheit von Anthrazyklinen entwickeln, können beobachtet werden, wenn sie symptomfrei bleiben und LVEF ≥ 40%. Dauernd niedrige oder weiter absinkende LVEF oder die Entwicklung von Symptomen sollten mit dem behandelnden Onkologen diskutiert werden:
|
II |
A |
|
Patienten, die linksventrikuläre Dysfunktion (LVD) entwickeln, sollten Leitlinien-basiert standard-therapiert werden so wie jeder andere Herzinsuffizienz-Patient. |
II |
A |
Zeichenerklärung
Quelle: Evidence Based Health Care -- Practice guidelines levels of evidence and grades of recommendations used by the National Guideline Clearinghouse (cached)
- I Nachweis durch Meta-Analyse von (einem oder mehreren) randomisierten kontrollierten Tests
- II Nachweis durch wenigstens eine kontrollierte nicht randomisierte Studie oder wenigstens einen anderen Typ einer quasi-experimentellen Studie
- III Nachweis durch nicht-experimentelle beschreibende Studien, wie vergleichende Studien, Korrelationsstudien und Fall-kontrollierte Studien.
- A Direkt auf Level-I-Nachweis basiert.
- B Direkt auf Level-II-Nachweis basiert oder von Level-I-Nachweis extrapolierte Empfehlung.
Summary
The risk of clinical cardiotoxicity increases with a cumulative dose. Studies evaluating cumulative probability of doxorubicin-induced HF have found rates in the range of
- 3%-5% with 400 mg/m2,
- 7%-26% at 550 mg/m2 and
- 18%-48% at 700 mg/m2.
The recommended maximum lifetime cumulative dose for doxorubicin is 400-550 mg/m2.
[Explanation of dosage:
Many chemotherapy drugs are dosed based on body surface area (BSA). This was just established a long time ago asuming that the patient with a larger BSA would also have larger organs etc for the drug to get cleared through. Today, actually, it can be determined that the clearance of these drugs are not actually related to BSA, but many are still dosed that way.
Therefore, the mg/m2 is actually mg per body surface area of your patient. Here is a diagram (in cache) that gives BSA using height and weight.
For 1.9 m2 body surface area (average for men) these doses are
- 3%-5% with 760 mg,
- 7%-26% at 1045 mg,
- 18%-48% at 1330 mg,
- recommended maximum lifetime cumulative dose for doxorubicin is 760 - 1045 mg.]
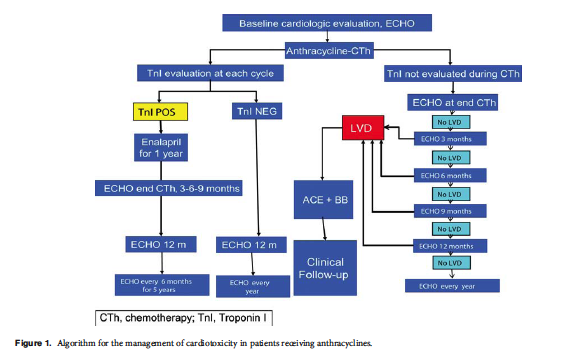
After treatment with anthracyclines, it is important to reassess cardiac function of all patients to identify asymptomatic patients who are experiencing increased cardiac damage;
- if LVEF has decreased by
- either 15 percentage-points,
- or 10 percentage-points to a value below 50
- or if troponin or BNP are elevated,
and a repeat assessment after 3 weeks confirms the finding;
alternative chemotherapeutic options should be discussed, as continuing treatment with an anthracycline carries increased risk for cardiotoxicity.
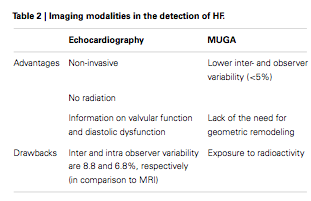
Considerable variation exists in the measurement of LVEF in that factors unrelated to the cancer drug may have a substantial impact on cardiac function. ... the LVEF measurement is a relatively insensitive tool for detecting cardiotoxicity at an early stage. This is largely because no considerable change in LVEF occurs until a critical amount of myocardial damage has taken place, and only comes to the forefront after compensatory mechanisms are exhausted. In addition, the measurement of LVEF presents a number of challenges related to image quality, assumption of LV geometry, load dependency and expertise.
- Magnetic resonance imaging (MRI) is considered the gold standard for the evaluation of LV volumes, mass and function. However, its lack of availability and high cost limit its routine use.
- Novel ultrasound imaging techniques, such as
- contrast echocardiography and
- real-time threedimensional (3D) echocardiography that allows for an improvement in the accuracy of calculating LVEF, are under investigation.
- Small studies examining
- tissue Doppler and
- strain rate imaging
appear to be promising in detecting early subclinical changes in cardiac performance that anticipate a decrease in conventional LVEF.
In the last decade, a new approach, based on the use of cardiac biomarkers, in particular troponins, has emerged, and has proven to be a more sensitive and more specific tool for early, real-time identification, assessment and monitoring of anticancer drug-induced cardiac injury [7, 8]. Strong data indicate that troponin detects anticancer drug induced-cardiotoxicity in its earliest phase, long before any reduction in LVEF has occurred
Treatment of anthracycline-induced cardiac dysfunction warrants aggressive intervention with standard modalities consistent with treatments for other forms of HF.
Treatment of anticancer drug-induced Left Ventricular Dysfunction (LVD)
All patients with cancer who are treated with potentially cardiotoxic therapy represent a high-risk group for the development of HF.
The use of Angiotensin-Converting Enzyme Inhibitors (ACE-I) and Beta-Blockers (BB) may be highly effective in this setting of patients.
- Recent findings reported in a large population of anthracycline-induced CMP patients demonstrated that the time elapsed from the end of chemotherapy to the start of HF therapy (time-to-treatment), with ACE-I and, when tolerated, with BB, is a crucial variable for recovery of cardiac dysfunction [29, 30]. Indeed, the likelihood of obtaining a complete LVEF recovery is higher in patients in whom treatment is initiated within 2 months from the end of chemotherapy. Although promising data have been published, convincing evidence from large randomized and prospective trials is still needed.
- Despite evidence, the potential efficacy of ACE-I and BB in improving LVEF in patients receiving trastuzumab remains uncertain
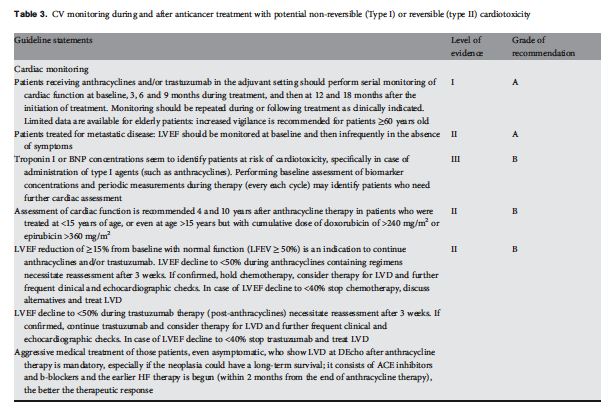
Management of trastuzumab cardiotoxicity
Management of trastuzumab-related cardiotoxicity has two distinct aspects:
- withdrawal of trastuzumab therapy and
- treatment of cardiac dysfunction
Symptomatic LVD must be treated with HF treatment:
- All patients with HF and an LVEF <40% should be treated with an ACE-I in combination with a BB unless a specific contraindication exists [I, A].
- Some members of the panel also felt that, to prevent further degradation of LVEF or the development of clinical HF, an ACE-I should be considered if the patient's LVEF is between 40% and 50%.
Asymptomatic LVD should be treated:
- ACE-Is should be used in all asymptomatic patients with LVD and an ejection fraction <40% [I, A for ejection fraction <35%; I, B for ejection fraction 35%-40%].
- Also, an ACE-I should be considered if LVEF is <50%.
- BB should be considered in all patients with asymptomatic LVD and an LVEF <40% [if prior myocardial infarction I, B; if no myocardial infarction II, C].
Although cardiac ischemia related to chemotherapy administration is an unusual occurrence, an increased risk of acute coronary syndrome has been associated with administration of cytotoxic and targeted agents for cancer treatment